Зміст
Одним з найважливіших сполук азоту є аміак. За фізичними властивостями це-безбарвний газ з різким, задушливим запахом (це запах водного розчину гідроксиду амонію NH₃ * H₂O). Газ добре розчиняється у воді. У водному розчині амоній є слабкою основою. Є одним з найважливіших продуктів хімічної промисловості.
NH₃-хороший редуктор, як у молекулі амонію, азот має найнижчий ступінь окислення -3. Багато характеристик аміаку визначаються парою одиночних електронів в атомі азоту - реакції приєднання з аміаком відбуваються через його присутність (ця пара одинаків розташована на вільній орбіті Протона H⁺).
Як отримати аміак

Існують два основних практичних методу отримання аміаку: один в лабораторії, інший - в промисловості.
Розглянемо отримання аміаку в промисловості. Взаємодія молекулярного азоту та водню: N₂ + 2H₂ = 2NH₃ (оборотна реакція). Цей метод отримання аміаку називається реакцією Хабера. Для молекулярного азоту і водню, які повинні прореагувати, їх необхідно нагріти до 500 ᵒC або 932 ᵒF, тиску MPA 25-30 необхідно створитися. Пористий праска повинен бути присутнім як каталізатор.
Отримання в лабораторії – це реакція між хлоридом амонію і гідроксидом кальцію: СА(OH)₂ + 2NH₄Cl = CaCl₂ + 2NH₄OH (як NH₄OH - дуже слабке з`єднання, воно відразу ж розпадається на газоподібний аміак і воду: NH₄OH = NH₃ + H₂O).
Реакція окислення аміаку
Вони протікають зі зміною стану окислення азоту. Так як аміак-хороший редуктор, його можна використовувати для зменшення важких металів від їх окисів.
Зменшення металів: 2NH₃ + 3cuo = 3cu + N₂ + 3H₂O (коли міді (II) оксид нагрівають в присутності аміаку, металева мідь червоного кольору зменшується).
Окислення аміаку в присутності сильних окислювачів (наприклад, галогенів) відбувається за рівнянням: 2NH₃ + 3cl₂ = N₂ + 6hcl (для проведення цієї окислювально-відновної реакції потрібне нагрівання). При впливі перманганату калію на аміак в лужне середовище спостерігається утворення молекулярного азоту, марганцевокислого калію і води: 2NH₃ + 6KMnO₄+ 6KOH = 6K₂MnO₄+ N₂ + 6H₂O.
При інтенсивному нагріванні (до 1200 °C або 2192 ᵒF) аміак може розпадатися на прості речовини: 2NH₃ = N₂ + 3H₂. На 1000 oC або 1832 аміак реагує з метаном CH4: 2CH₄ + 2NH₃ + 3O₂ = 2HCN + 6H₂O (синильної кислоти і води). Шляхом оксидації аміаку з гіпохлоритом натрію гідразин Н₂Х можно можна отримати: 2NH3 + NaOCl = N2H4 + NaCl + H2O
Спалювання аміаку і його каталітичне окислення киснем

Окислення аміаку киснем має певні особливості. Існує два різних типи окислення: Каталітичний (з каталізатором), швидкий (Gorenje).
При Gorenje відбувається окислювально-відновна реакція, продуктами якої є молекулярний азот і вода: 4NH3 + 2O2 = 2N2 + 6H2O (полум`я жовто-зелене, Gorenje починається при 651 або 103,8 градусів за Фаренгейтом, оскільки це температура самозаймання аміаку). Каталітичне окислення киснем також відбувається при нагріванні (близько 800 ᵒC або 1472 ᵒF), але один з продуктів реакції відрізняється: 4NH₃ + 5O₂ = 4NO + 6H₂O (в присутності платини або оксидів заліза, марганцю, хрому або кобальту в якості каталізатора продуктами окислення є оксид азоту (II) і вода).
Розглянемо однорідне окислення аміаку киснем. Безконтрольна однотипна оксидація ділянки газу аміаку-відносно повільна реакція. Про неї не повідомляється докладно, але нижня межа займистості аміачно-повітряних сумішей при 25 оС становить близько 15% в інтервалі тисків 1-10 бар і зменшується в міру підвищення початкової температури газової суміші.
Якщо CNH~ - це молева частка NH3 у суміші повітря-аміак з температурою tmixed (OC), то з даних CNH = 0.15-0 випливає, що межа займистості низький. Тому розумно працювати з достатнім запасом міцності нижче нижньої межі займистості, як правило, дані про змішування аміаку з повітрям часто далекі від досконалості.

Хімічна властивість
Розглянемо контактне окислення аміаку до оксиду азоту. Типові хімічні реакції з аміаком без зміни ступеня окислення азоту:
- Реакція з водою: NH₃ + H₂O = NH₄OH = NH₄ ⁺ + oh⁻ (реакція оборотна, оскільки гідроксид амонію NH₄OH є нестійкою сполукою).
- Реакція з кислотами з утворенням нормальних і кислих солей: NH₃ + HCl = NH₄Cl (нормальний хлорид амонію солі сформований);NH₃ + H₂SO₄ = NH₄HSO₄ (в реакції аміаку з холодною концентрованої сірчаної кислотою утворюється кислотна сіль гідросульфат амонію); 2NH₃ + H₂SO₄ = (NH₄)₂SO₄.
- Реакції з солями важких металів з утворенням комплексів: 2NH₃ + AgCl = [Ag(NH₃)₂]Cl (складні сполуки срібла (I) хлоридні форми діаміну).
- Реакція з галогеналканами: NH3 + CH3Cl = [CH3NH3]Cl (форми метиламонію гідрохлориду-це заміщений іон амонію NH4=).
- Реакція з лужними металами: 2NH₃ + 2K = 2KNH₂ + H₂ (утворюється амід калію KNH₂; азот не змінює стан окислення, хоча реакція окисно-відновна). Реакції приєднання відбуваються в більшості випадків без зміни стану окислення (всі перераховані вище, крім останньої, класифікуються даним типом).

Укладення
Аміак-популярна речовина, яка активно використовується в промисловості. На сьогоднішній день вона займає особливе місце в нашому житті, так як більшість продуктів її діяльності ми використовуємо щодня. Ця стаття буде корисна для прочитання багатьом, хто захоче дізнатися про те, що нас оточує.
 Структура закону та його властивості
Структура закону та його властивості Клей пластилін, його властивості і застосування
Клей пластилін, його властивості і застосування Продукти бджільництва. Перга: корисні властивості, як приймати, як зберігати
Продукти бджільництва. Перга: корисні властивості, як приймати, як зберігати Оксид пропілену: формула, властивості, застосування та виробництво
Оксид пропілену: формула, властивості, застосування та виробництво Ферменти мікроорганізмів: способи утворення, класифікація та властивості
Ферменти мікроорганізмів: способи утворення, класифікація та властивості Яйця: корисні властивості, хімічний склад і харчова цінність
Яйця: корисні властивості, хімічний склад і харчова цінність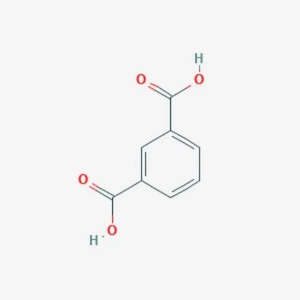 Ізофталева кислота: опис, властивості, отримання та застосування
Ізофталева кислота: опис, властивості, отримання та застосування Каепутовое масло: властивості і застосування
Каепутовое масло: властивості і застосування Артишок польовий: корисні властивості і протипоказання
Артишок польовий: корисні властивості і протипоказання