Фізику будови речовини вперше серйозно почав вивчати Джозеф Дж. Томсон. Однак багато питань залишалися у нього без відповіді. Через деякий час Е. Резерфорд зміг сформулювати модель будови атома. У статті ми розглянемо досвід, який привів його до відкриття. Ґатунок. до. на уроках фізики будова речовини-це одна з найцікавіших тим, ми розберемо її ключові аспекти. Дізнаємося, з чого складається атом, навчимося знаходити кількість електронів, протонів, нейтронів в ньому. Познайомимося з поняттям ізотопів та іонів.
Відкриття електрона
У 1897 р. англійський учений Джозеф Джон Томсон (його портрет можна побачити нижче) вивчав електричний струм, т. е. спрямований рух зарядів в газах. У той час про молекулярну будову речовини Фізика вже знала. Відомо, що всі тіла складаються з речовини, яка складається з молекул, а останні-з атомів.

Томсон виявив, що за певних умов атоми газу випромінюють частинки з негативним зарядом (qел <0). Вони отримали назву електронів. Атом нейтральний, значить, якщо електрони вилітають з нього, то там повинні міститися і позитивні частинки. Що ж собою являє частина атома зі знаком "+"? Як вона взаємодіє з негативно зарядженим електроном? Що визначає масу атома? Відповісти на всі ці питання зміг інший вчений.
Досвід Резерфорда
Початковими відомостями про будову речовини Фізика в 1911 р. вже володіла. Ернест Резерфорд виявив те, що ми сьогодні називаємо атомним ядром.

Існують матерії, що володіють дивним властивістю: вони мимовільно випускають різні частинки, як позитивні, так і негативні. Такі речовини отримали назву радіоактивних. Позитивно заряджені елементи Резерфорд назвав альфа-частинками (α-частинками).
Вони мають заряд зі знаком "+", дорівнює двом елементарним (qα = +2e). Вага елементів приблизно дорівнює чотирьом масам атома водню. Резерфорд взяв радіоактивний препарат, який випускає альфа-частинки, і їх потоком бомбардував тонку плівку золота (фольгу).
Він виявив, що більшість α-елементів майже не змінюють свого напрямку, проходячи через атоми металу. Але існує дуже невелика кількість тих, які відхиляються назад. Чому так відбувається? Знаючи фізику будови речовини, можна відповісти: тому що всередині атомів золота, як і будь-яких інших, існують позитивні елементи, які відштовхують альфа-частинки. Але чому це відбувається лише з дуже малою кількістю елементів? Тому що розміри позитивно зарядженої частини атома набагато менше його самого. До цього висновку і прийшов Резерфорд. Позитивно заряджену частину атома він назвав ядром.
Пристрій атома
Фізика будови речовини: молекули складаються з атомів, які містять крихітну позитивно заряджену частину (ядро), оточену електронами. Нейтральність атома пояснюється тим, що сумарний негативний заряд електронів дорівнює позитивному-ядра. qядро + qел=0. Чому ж електрони не падають на ядро, адже вони ж притягуються? Щоб відповісти на це питання, Резерфорд припустив, що вони обертаються, як планети рухаються навколо Сонця і не стикаються з ним. Саме рух дозволяє цій системі бути стабільною. Модель атома, придумана Резерфордом, отримала назву планетарної.
Якщо атом нейтральний, а число електронів в ньому обов`язково має бути цілим, то заряд ядра дорівнює цій величині зі знаком плюс. qядро= +z * e. z-це кількість електронів у нейтральному атомі. В такому випадку сумарний заряд дорівнює нулю. Як дізнатися число електронів в атомі? Потрібно скористатися періодичною системою елементів. Розміри атома мають порядок 10-10 м. А ядра в 100 тисяч разів менше-10-15 м.
Уявімо, що ми збільшили розміри ядра до 1 метра. У твердому тілі відстань між атомами приблизно дорівнює величині їх самих, значить, розміри збільшаться до 105, а це 100 км. Тобто атом практично складається з порожнечі, ось чому альфа-частинки в основному пролітають крізь фольгу, майже не відхиляючись.
Будова ядра
Фізика будови речовини така, що ядро складається з частинок двох сортів. Деякі з них мають позитивним зарядом. Якщо ми розглядаємо атом, у якого три електрони, то всередині нього-три частинки з позитивним зарядом. Вони називаються протони. Інші елементи не володіють електричним зарядом-нейтрони.

Маси протона і нейтрона приблизно рівні. І та, і інша частинки мають вагу, набагато більшу, ніж електрон. mпротон ≈ 1837mел. Те ж стосується і маси нейтрона. З цього випливає висновок: вага позитивно і нейтрально заряджена частинка - фактор, що визначає масу атома. У протонів і нейтронів є загальна назва-нуклони. Вага атома визначається їх кількістю, яка називається масовим числом ядра. Число електронів в атомі ми позначили буквою z, але т. до. він нейтральний, то кількість позитивних і негативних частинок має збігатися. Тому z ще називають протонним або зарядовим числом.
Якщо відомі масове і зарядове число, то ми можемо знайти і кількість нейтронів N. N = A - z. Як дізнатися, скільки нуклонів і протонів знаходиться в ядрі? Виявляється, в таблиці Менделєєва біля кожного елемента вказано число, яке хіміки називають відносною атомною масою.

Якщо його округлити, отримаємо не що інше, як масове число або кількість нуклонів в ядрі (А). Порядковий номер елемента являє собою кількість протонів (z). Знаючи А і z, легко знайти n-число нейтронів. Якщо атом нейтральний, то кількість електронів і протонів дорівнює.
Ізотоп
Існують різновиди ядра, в якому число протонів збігається, а кількість нейтронів може відрізнятися (мається на увазі один і той же хімічний елемент). Їх називають ізотопами. У природі атоми різних сортів перемішалися, тому хіміки вимірюють усереднену масу. Саме тому в таблиці Менделєєва відносна вага атома-це завжди дробове число. Розберемося, що станеться з нейтральним атомом, якщо прибрати з нього електрон або, навпаки, помістити зайвий.
Іон

Розглянемо нейтральний атом літію. Є ядро, два електрони розташовані на одній оболонці і три-на іншій. Якщо ми заберемо один з них, вийде позитивно заряджене ядро. qядро = 3е. Електрони компенсують лише два з трьох елементарних зарядів, і ми отримуємо позитивний іон. Він позначається так: Li+. Іон-це атом, у якого кількість електронів менше або більше числа протонів в ядрі. У першому випадку-це позитивний іон. Якщо ми додамо зайвий електрон, то їх буде вже чотири, і ми отримаємо негативний іон (Li-). Така Фізика будови речовини. Отже, нейтральний атом від іона відрізняється тим, що в ньому електрони повністю компенсують заряд ядра.
 Обмінні процеси в організмі. Речовини, що беруть участь в обміні речовин. Як підвищити метаболізм
Обмінні процеси в організмі. Речовини, що беруть участь в обміні речовин. Як підвищити метаболізм Що це-щільність металів, як вона визначається? Розрахунок щільності для осмію
Що це-щільність металів, як вона визначається? Розрахунок щільності для осмію Гормони рослин: опис речовини, особливості
Гормони рослин: опис речовини, особливості Повітроплавання (фізика). Повітроплавання в росії
Повітроплавання (фізика). Повітроплавання в росії Для чого потрібен розрахунковий рахунок для іп? Безготівковий розрахунок для іп. Де вигідніше відкрити розрахунковий рахунок для іп
Для чого потрібен розрахунковий рахунок для іп? Безготівковий розрахунок для іп. Де вигідніше відкрити розрахунковий рахунок для іп Вітаміни для молодості і краси: необхідні речовини, корисні властивості, застосування
Вітаміни для молодості і краси: необхідні речовини, корисні властивості, застосування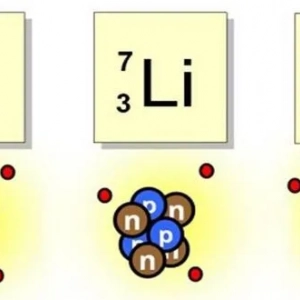 Ізотоп літію: визначення та застосування
Ізотоп літію: визначення та застосування Продукти життєдіяльності. Які речовини необхідні для життєдіяльності організму? Біологія
Продукти життєдіяльності. Які речовини необхідні для життєдіяльності організму? Біологія Що таке молярна маса? Молярна маса в хімії та фізиці газів
Що таке молярна маса? Молярна маса в хімії та фізиці газів