Зміст
Вивчення властивостей і поведінки ідеального газу є ключовим моментом для розуміння фізики цього напрямку в цілому. Розглянемо в даній статті, що включає в себе концепція ідеального одноатомного газу, якими рівняннями описуються його стан і внутрішня енергія. А також вирішимо пару завдань по цій темі.
Загальне поняття
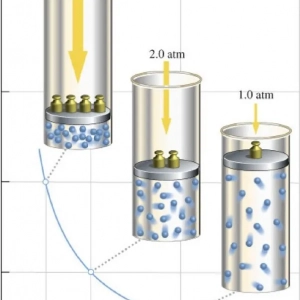
Кожен школяр знає, що газ-це одне з трьох агрегатних станів речовини, яке, на відміну від твердого і рідкого, не зберігає обсяг. Крім того, він також не зберігає свою форму і завжди заповнює повністю наданий йому обсяг. Насправді остання властивість відноситься до так званих ідеальних газів.
Концепція ідеального газу тісно пов`язана з молекулярно-кінетичною теорією (МКТ). Відповідно до неї частинки газової системи рухаються хаотично у всіх напрямках. Їх швидкості підкоряються розподілу Максвелла. Частинки не взаємодіють один з одним, і відстані між ними набагато перевищують їх розміри. Якщо всі перераховані умови дотримуються з певною точністю, то газ можна вважати ідеальним.
Будь-які реальні середовища близькі за своєю поведінкою до ідеальних, якщо вони мають невисокі щільності і високі абсолютні температури. Крім того, вони повинні складатися з хімічно неактивних молекул або атомів. Так, водяна пара через присутність між молекулами H2O сильних водневих взаємодій не вважається ідеальним газом, а повітря, що складається з неполярних молекул, є ним.

Закон Клапейрона-Менделєєва
Під час аналізу, з точки зору МКТ, поведінки газу в рівновазі можна отримати наступне рівняння, яке пов`язує основні термодинамічні параметри системи:
P * V = n * R * T.
Тут тиск, об`єм і температура позначені латинськими літерами P, V і T відповідно. Величина n-це кількість речовини, яка дозволяє визначити число частинок в системі, R-газова постійна, що не залежить від хімічної природи газу. Вона дорівнює 8,314 Дж / (до * моль), тобто будь-який ідеальний газ в кількості 1 моль при його нагріванні на 1 до, розширюючись, здійснює роботу 8,314 Дж.
Записана рівність називається універсальним рівнянням стану Клапейрона-Менделєєва. Чому? Названо воно так на честь французького фізика Еміля Клапейрона, який в 30-і роки XIX століття, вивчаючи встановлені до цього Експериментальні газові закони, записав його в загальному вигляді. Згодом Дмитро Менделєєв привів його до сучасної форми, ввівши константу R.

Внутрішня енергія одноатомного середовища
Одноатомний ідеальний газ відрізняється від багатоатомного тим, що його частинки мають лише три ступені свободи (поступальний рух уздовж трьох осей простору). Цей факт призводить до наступної формули середньої кінетичної енергії одного атома:
m * v2 / 2 = 3 / 2 * kB * T.
Швидкість v називається середньою квадратичною. Маса атома і постійна Больцмана позначена як m і kB відповідно.

Згідно з визначенням внутрішньої енергії, вона являє собою суму кінетичної і потенційної складових. Розглянемо детальніше. Так як потенційною енергією ідеальний газ не володіє, то його внутрішня енергія-це енергія кінетична. Яка її формула? Розраховуючи енергію всіх частинок N в системі, отримаємо наступний вираз для внутрішньої енергії u одноатомного газу:
U = 3 / 2 * n * R * T.
Приклади по темі
Завдання №1. Ідеальний одноатомний газ переходить зі стану 1 в стан 2. Маса газу при цьому залишається постійною (закрита система). Необхідно визначити зміну внутрішньої енергії середовища, якщо перехід є ізобарним при тиску, Рівному одній атмосфері. Дельта об`єму посудини з газом склала три літри.
Випишемо формулу для зміни внутрішньої енергії U:
ΔU = 3 / 2 * n * R * ΔT.
Скористатися рівнянням Клапейрона-Менделєєва, цей вираз можна переписати у вигляді:
ΔU = 3 / 2 * P * ΔV.
Тиск і зміна обсягу нам відомо з умови завдання, тому залишається перевести їх значення в СІ і підставити в формулу:
ΔU = 3 / 2 * 101325 * 0,003 ≈ 456 Дж.
Таким чином, коли одноатомний ідеальний газ переходить зі стану 1 в стан 2, його внутрішня енергія зростає на 456 Дж.
Завдання № 2. Ідеальний одноатомний газ в кількості 2 моль знаходився в посудині. Після ізохорного нагрівання його енергія зросла на 500 Дж. Як змінилася при цьому температура системи?

Знову випишемо формулу для зміни величини U:
ΔU = 3 / 2 * n * R * ΔT.
З неї нескладно висловити величину зміни абсолютна температура ΔT, маємо:
ΔT = 2 * ΔU / ( 3 * n * R ).
Підставляючи дані для ΔU і n з умови, отримуємо відповідь: ΔT = + 20 K.
Важливо розуміти, що всі наведені розрахунки справедливі тільки для одноатомного ідеального газу. Якщо система утворена багатоатомними молекулами, то формула для U вже буде не вірна. Закон Клапейрона-Менделєєва справедливий для будь-якого ідеального газу.
 Механічна робота у фізиці. Формула і приклади задач
Механічна робота у фізиці. Формула і приклади задач Рівняння менделєєва-клапейрона для вирішення задач з термодинаміки
Рівняння менделєєва-клапейрона для вирішення задач з термодинаміки Концентрація молекул ідеального газу. Формули і приклад задачі
Концентрація молекул ідеального газу. Формули і приклад задачі Ізохорна теплоємність ідеального газу
Ізохорна теплоємність ідеального газу Податок на потужність двигуна: ставки, формула розрахунку
Податок на потужність двигуна: ставки, формула розрахунку Альтернативна електрика: методи отримання енергії, необхідне обладнання
Альтернативна електрика: методи отримання енергії, необхідне обладнання Ідеальний газ. Рівняння клапейрона-менделєєва. Формули і приклад задачі
Ідеальний газ. Рівняння клапейрона-менделєєва. Формули і приклад задачі Показники адіабати: визначення та процес
Показники адіабати: визначення та процес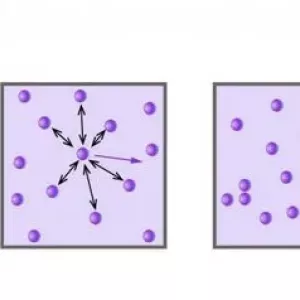 Рівняння менделєєва-клапейрона. Приклад завдання
Рівняння менделєєва-клапейрона. Приклад завдання