Зміст
Газ є одним з чотирьох агрегатних станів навколишнього нас матерії. Цей стан речовини людство почало вивчати із застосуванням наукового підходу, починаючи з XVII століття. У наведеній нижче статті вивчимо, що таке ідеальний газ, і рівняння яке описує його поведінка при різних зовнішніх умовах.
Поняття про ГАЗ ідеальному
Кожна людина знає, що Повітря, яким ми дихаємо, або природний метан, який ми використовуємо для обігріву будинків і приготування їжі, це яскраві представники газового стану матерії. У фізиці для вивчення властивостей цього стану було введено поняття ідеального газу. Це поняття передбачає використання ряду припущень і спрощень, які не є суттєвими при описі базових фізичних характеристик речовини: температури, об`єму і тиску.

Отже, ідеальним газом називається Текуча субстанція, яка задовольняє наступні умови:
- Частинки (молекули та атоми) рухаються хаотично в різних напрямках. Завдяки цій властивості в 1648 році Ян Баптиста ван Гельмонт ввів поняття "газ" ("хаос" з давньогрецької).
- Частинки не взаємодіють один з одним, тобто міжмолекулярними і міжатомними взаємодіями можна знехтувати.
- Зіткнення між частинками і зі стінками судини є абсолютно пружними. В результаті таких зіткнень зберігається кінетична енергія і кількість руху (імпульс).
- Кожна частинка являє собою матеріальну точку, тобто вона має деяку кінцеву масу, але її об`єм дорівнює нулю.
Сукупність викладених умов відповідає поняттю ідеального газу. Всі відомі реальні речовини з високою точністю відповідають введеної концепції при високих температурах (кімнатної і вище) і низьких тисках (атмосферного і нижче).
Закон Бойля-Маріотта

Перш ніж записати рівняння стану ідеального газу, наведемо ряд приватних законів і принципів, експериментальне відкриття яких призвело до висновку цього рівняння.
Почнемо з закону Бойля-Маріотта. У 1662 році британський фізико-хімік Роберт Бойль і в 1676 французький фізико-ботанік ЕДМ Маріотт незалежно встановили наступний закон: якщо температура в газовій системі залишається постійною, то створюване газом тиск в ході будь-якого термодинамічного процесу виявляється обернено пропорційним його обсягом. Математично це формулювання може бути записана наступним чином:
P * V = k1 при T = const, де
- P, V-тиск і обсяг ідеального газу;
- k1 - деяка константа.
Проводячи експерименти з хімічно різними газами, вчені встановили, що величина k1 не залежить від хімічної природи, але залежить від маси газу.
Перехід між станами зі зміною тиску і обсягу при збереженні температури системи називається ізотермічним процесом. Таким чином, ізотерми ідеального газу на графіку являють собою гіперболи залежності тиску від обсягу.
Закон Шарля і Гей-Люссака
У 1787 році французький вчений Шарль і в 1803 році інший француз Гей-Люссак емпіричним шляхом встановили ще один закон, який описував поведінку ідеального газу. Його можна сформулювати так: в закритій системі при постійному тиску газу збільшення температури призводить до пропорційного збільшення обсягу і, навпаки, зменшення температури веде до пропорційного стиснення газу. Математичне формулювання закону Шарля і Гей-Люссака записується так:
V / T = k2 при P = const.
Перехід між станами газу зі зміною температури і об`єму і при збереженні тиску в системі називається ізобарним процесом. Константа k2 визначається значенням тиску в системі і масою газу, але не його хімічною природою.
На графіку функція V (T) являє собою пряму лінію з дотичним кутом нахилу k2.
Зрозуміти цей закон можна, якщо залучити положення молекулярно-кінетичної теорії (МКТ). Так, збільшення температури призводить до збільшення кінетичної енергії газових частинок. Останнє сприяє підвищенню інтенсивності зіткнень їх зі стінками судини, що збільшує тиск в системі. Щоб цей тиск зберегти постійним, необхідно об`ємне розширення системи.

Закон Гей-Люссака
Вже згаданий французький вчений на початку XIX століття встановив ще один закон, пов`язаний з термодинамічними процесами ідеального газу. Цей закон говорить: якщо в газовій системі зберігається постійний обсяг, то збільшення температури позначається на пропорційному підвищенні тиску, і навпаки. Формула закону Гей-Люссака виглядає так:
P / T = k3 при V = const.
Знову ми маємо константу k3, залежну від маси газу і його обсягу. Термодинамічний процес при постійному обсязі називається ізохорним. Ізохори на графіку P (T) виглядають так само, як ізобари, тобто є прямими лініями.
Принцип Авогадро
При розгляді рівняння стану ідеального газу часто дають характеристику тільки трьом законам, які представлені вище і які є особливими випадками цього рівняння. Проте існує ще один закон, який прийнято називати принципом Амедео Авогадро. Він також представляє окремий випадок рівняння ідеального газу.
У 1811 році італієць Амедео Авогадро в результаті численних експериментів з різними газами прийшов до наступного висновку: якщо тиск і температура в газовій системі зберігається, то її обсяг V знаходиться в прямій пропорційності від кількості речовини n. При цьому неважливо, який хімічної природи є речовина. Авогадро встановив наступне співвідношення:
n / V = k4,
де константа k4 визначається тиском і температурою в системі.
Принцип Авогадро іноді формулюють так: обсяг, який займає 1 моль ідеального газу при даній температурі і тиску, є завжди одним і тим же, незалежно від його природи. Нагадаємо, що 1 моль речовини-це число NA, відображає кількість елементарних одиниць (атомів, молекул), що складають речовину (NA = 6,02 * 1023).
Закон Менделєєва-Клапейрона

Тепер настав час повернутися до головної теми статті. Будь-який ідеальний газ у рівновазі може бути описаний наступним рівністю:
P * V = n * R * T.
Цей вислів називається законом Менделєєва-Клапейрона - за прізвищами вчених, які внесли величезний вклад в його формулювання. Закон говорить, що добуток тиску на об`єм газу є прямо пропорційним добутку кількості речовини цього газу на його температуру.
Клапейрон вперше отримав цей закон, узагальнюючи результати досліджень Бойля-Маріотта, Шарля, Гей-Люссака і Авогадро. Заслуга ж Менделєєва в тому, що він надав основному рівнянню ідеального газу сучасну форму, ввівши константу R. Клапейрон у своїй математичній формулюванні використовував набір констант, що робило незручним використання цього закону для вирішення практичних задач.
Введена Менделєєвим величина R називається універсальної газової постійної. Вона показує, яку роботу здійснює 1 моль газу будь-якої хімічної природи в результаті ізобарного розширення при збільшенні температури на 1 Кельвін. Через постійну Авогадро NA і константу Больцмана kB ця величина розраховується так:
R = NA * kB = 8,314 Дж/(моль*К).

Виведення рівняння
Сучасний стан термодинаміки і статистичної фізики дозволяє отримати декількома різними способами рівняння ідеального газу, записане в попередньому пункті.
Перший спосіб полягає в узагальненні всього двох емпіричних законів: Бойля-Маріотта і Шарля. З цього узагальнення випливає вид:
P * V / T = const.
Саме так вчинив Клапейрон в 30 - і роки XIX століття.
Другий спосіб полягає в залученні положень МКТ. Якщо розглянути імпульс, який передає при зіткненні зі стінкою судини кожна частка, врахувати зв`язок цього імпульсу з температурою, а також врахувати число частинок N в системі, то можна записати з кінетичної теорії рівняння ідеального газу в такому вигляді:
P * V = N * kB * T.
Помноживши і поділивши праву частину рівності на число NA, ми отримаємо рівняння в тому вигляді, в якому воно записано в пункті вище.
Існує третій більш складний спосіб отримання рівняння стану ідеального газу - з статистичної механіки з використанням поняття вільної енергії Гельмгольца.
Запис рівняння через масу газу і щільність

Вище на малюнку записано рівняння газу ідеального. У ньому фігурує кількість речовини n. Однак на практиці часто відома змінна або постійна маса ідеального газу m. В цьому випадку рівняння запишеться в такій формі:
P * V = m / M * R * T.
M-маса молярна для даного газу. Наприклад, для кисню O2 вона дорівнює 32 г / моль.
Нарешті, перетворюючи останній вираз, можна переписати його так:
P = ρ / M * R * T
Де ρ-щільність субстанції.
Суміш газів

Суміш ідеальних газів описується так званим законом Дальтона. Цей закон випливає з рівняння ідеального газу, яке застосовується для кожного компонента суміші. Дійсно, кожен компонент займає весь обсяг і має однакову з іншими компонентами суміші температуру, що дозволяє записати:
P = ∑iPi = R * T / V * ∑ini.
Тобто повний тиск в суміші P дорівнює сумі парціальних тисків Pi всіх компонент.
 Рівняння стану ідеального газу і сенс абсолютної температури
Рівняння стану ідеального газу і сенс абсолютної температури Рівняння стану ідеального газу. Історичні передумови, формули і приклад завдання
Рівняння стану ідеального газу. Історичні передумови, формули і приклад завдання Рівняння менделєєва-клапейрона для вирішення задач з термодинаміки
Рівняння менделєєва-клапейрона для вирішення задач з термодинаміки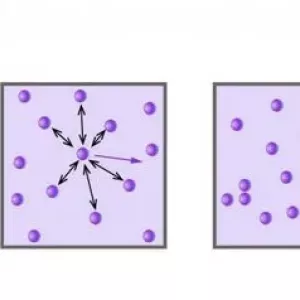 Рівняння менделєєва-клапейрона. Приклад завдання
Рівняння менделєєва-клапейрона. Приклад завдання Концентрація молекул ідеального газу. Формули і приклад задачі
Концентрація молекул ідеального газу. Формули і приклад задачі Фізична модель ідеального газу. Модель ідеального газу. Властивості газів
Фізична модель ідеального газу. Модель ідеального газу. Властивості газів Процеси ізобарний, ізохорний, ізотермічний та адіабатний для ідеального газу
Процеси ізобарний, ізохорний, ізотермічний та адіабатний для ідеального газу Ідеальний газ. Рівняння клапейрона-менделєєва. Формули і приклад задачі
Ідеальний газ. Рівняння клапейрона-менделєєва. Формули і приклад задачі Безперервна розливання сталі: принцип роботи, необхідне обладнання, переваги і недоліки методу
Безперервна розливання сталі: принцип роботи, необхідне обладнання, переваги і недоліки методу